
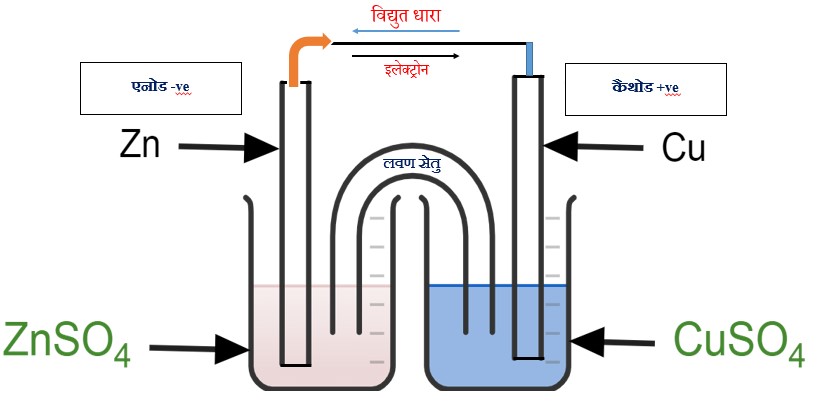
डेनियल सेल (GALVANIC CELL)
डेनियल सेल – इस सेल में एक पात्र में CuSO4 का विलयन भरकर समय उसमें Cu इलेक्ट्रोड लगाते हैं तथा दूसरे पात्र में ZnSO4 का विलयन भरकर का Zn इलेक्ट्रोड लगाते हैं दोनों पात्रों को U – आकार की नलिका के द्वारा जोड़ते हैं इस नलिका को लवण सेतु कहते हैं इस नली में KCl , KNO3, NH4NO3 को अगार-अगार के साथ गर्म करके तथा ठंडा करके बनाया गया जेली जैसा मिश्रण होता है Cu इलेक्ट्रोड तथा Zn इलेक्ट्रोड को एक अमीटर के साथ धात्विक तार के द्वारा जोड़ देते हैं।
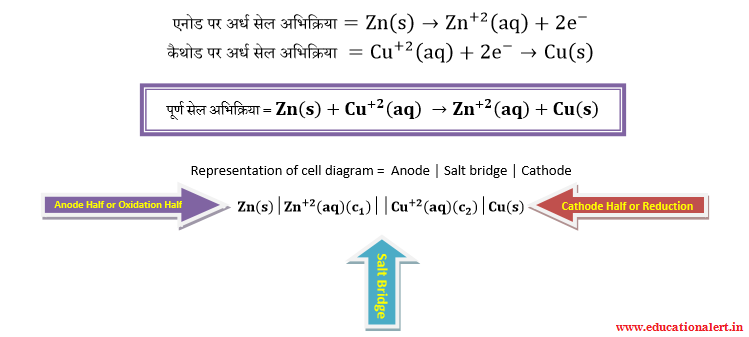
इलेक्ट्रोड पर अभिक्रियाएँ
उपरोक्त सेल में सभी स्पीशीज की सांद्रता जब इकाई (1M) होती है तब इसका विद्युत वाहक बल का मान 1.10 VOLT होता है व सेल को गैल्वेनिक सेल या वोल्टीय सेल कहा जाता है।
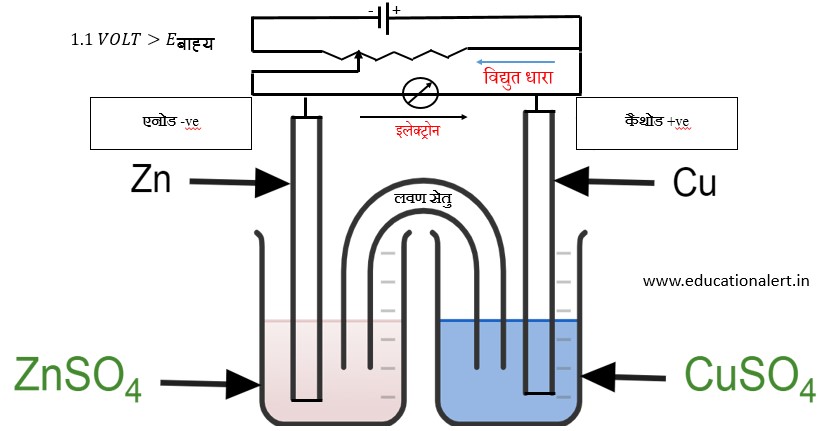
(A) जब Eबाह्य < 1.1 Volt हो तो इलेक्ट्रॉनों का प्रवाह Zn से Cu की और तथा धारा का प्रवाह Cu से Zn की और
एनोड पर Zn का विघटन
![]()
कैथोड पर Cu का निक्षेपण
![]()
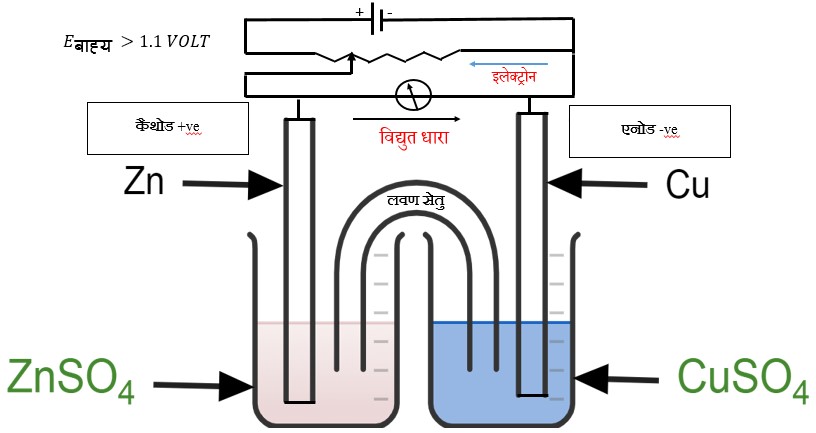
(B) जब Eबाह्य > 1.1 Volt हो तो इलेक्ट्रॉनों का प्रवाह Cu से Zn की और तथा धारा का प्रवाह Zn से Cu की और
एनोड पर Cu का विघटन
![]()
कैथोड पर Zn का निक्षेपण
![]()
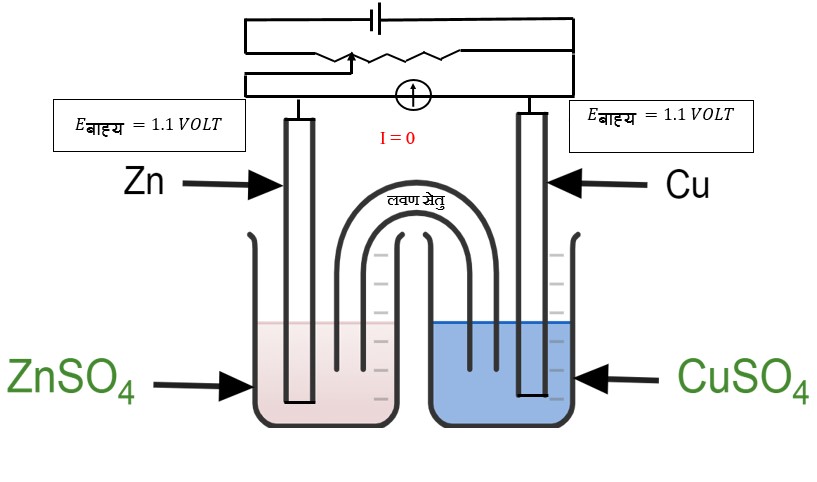
(C) जब Eबाह्य = 1.1 Volt हो तो यह सेल कोई अभिक्रिया नहीं दर्शाता है एवं विद्युत धारा का कोई प्रवाह नहीं होता है।
Thanks
sundar notes