
अज्ञात इलेक्ट्रोड के इलेक्ट्रोड विभव की गणना
अज्ञात इलेक्ट्रोड के इलेक्ट्रोड विभव की गणना करने के लिए मानक हाइड्रोजन इलेक्ट्रोड(SHE) को एनोड के रूप में बाई तरफ या कैथोड के रूप में दाईं तरफ तथा अज्ञात विभव वाले इलेक्ट्रोड को कैथोड के रूप में दाईं तरफ या एनोड के रूप में बाई तरफ लगाकर सेल बनाते हैं तथा वोल्टमीटर की सहायता से सेल विभव की गणना कर सकते हैं।
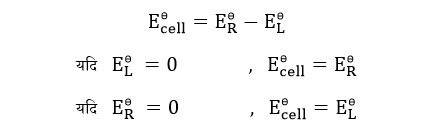
अतः वोल्ट मीटर के द्वारा बताया गया सेल विभव अज्ञात इलेक्ट्रोड के मानक इलेक्ट्रोड को ही बताता है।
अज्ञात कॉपर इलेक्ट्रोड का विभव ज्ञात करना
अज्ञात इलेक्ट्रोड (Cu) के इलेक्ट्रोड विभव की गणना करने के लिए मानक हाइड्रोजन इलेक्ट्रोड (SHE) को एनोड के रूप में बाई तरफ तथा अज्ञात विभव वाले इलेक्ट्रोड को कैथोड के रूप में दाईं तरफ लगाकर सेल बनाते हैं तथा वोल्टमीटर की सहायता से सेल विभव की गणना करते हैं।
उपरोक्त प्रकार से ज्ञात किया गया इलेक्ट्रोड विभव यदि किसी तत्व के लिए धनात्मक आता है तो इसका अर्थ है कि उस तत्व की अपचयित अवस्था हाइड्रोजन की अपचयित अवस्था से अधिक स्थाई है उपरोक्त में Cu इलेक्ट्रोड पर अपचयन हो रहा है क्योकि धारा Cu से मानक हाइड्रोजन इलेक्ट्रोड (SHE) की तरफ आ रही है अतः इलेक्ट्रॉन मानक हाइड्रोजन इलेक्ट्रोड (SHE) इलेक्ट्रोड से Cu की ओर गति करेंगे अतः इसमें मानक हाइड्रोजन इलेक्ट्रोड (SHE) ऋण इलेक्ट्रोड(एनोड) तथा Cu धन इलेक्ट्रोड (कैथोड) होगा वोल्ट मीटर से पता चलता है कि सेल विभव का मान 0.34 V है निम्न प्रकार अज्ञात इलेक्ट्रोड अर्थात Cu इलेक्ट्रोड का विभव ज्ञात कर लेते है।

धनात्मक मान इंगित करता है कि Cu+2 आयन H+ आयनो की तुलना में आसानी से अपचयित हो जाते हैं इसका विपरीत प्रक्रम नहीं होता है अर्थात उपरोक्त मानक परिस्थितियों में H+ आयन Cu को आक्सीकृत नहीं कर सकते अथवा हम यह भी कह सकते हैं कि हाइड्रोजन गैस Cu+2 आयनो को अपचयित कर सकती है इसलिए कॉपर HCl में नहीं घुलता है।
Note – यदि किसी तत्व का इलेक्ट्रोड विभव ऋणात्मक आता है तो इसका अर्थ है कि उस तत्व की आक्सीकृत अवस्था हाइड्रोजन की आक्सीकृत अवस्था से अधिक स्थाई है।
अज्ञात जिंक इलेक्ट्रोड का विभव ज्ञात करना
अज्ञात इलेक्ट्रोड (Zn) के इलेक्ट्रोड विभव की गणना करने के लिए मानक हाइड्रोजन इलेक्ट्रोड (SHE) को कैथोड के रूप में बाई तरफ तथा अज्ञात विभव वाले इलेक्ट्रोड को एनोड के रूप में दाईं तरफ लगाकर सेल बनाते हैं तथा वोल्टमीटर की सहायता से सेल विभव की गणना करते हैं।अज्ञात जिंक इलेक्ट्रोड को मानक हाइड्रोजन इलेक्ट्रोड (SHE) के साथ लवण सेतु की सहायता से जोड़ देते हैं। वोल्ट मीटर द्वारा पता चलता है कि विद्युत धारा मानक हाइड्रोजन इलेक्ट्रोड (SHE) की तरफ से अज्ञात जिंक इलेक्ट्रोड की ओर प्रवाहित हो रही है अतः इलेक्ट्रॉन जिंक इलेक्ट्रोड से मानक हाइड्रोजन इलेक्ट्रोड (SHE) की ओर गति करेंगे अतः इनमें Zn इलेक्ट्रोड पर ऑक्सीकरण तथा मानक हाइड्रोजन इलेक्ट्रोड (SHE) पर अपचयन होगा इनमें जिंक इलेक्ट्रोड ऋण तथा मानक हाइड्रोजन इलेक्ट्रोड (SHE) धन इलेक्ट्रोड होगा वोल्ट मीटर द्वारा दोनों के विभवो का अंतर ज्ञात कर लेते हैं इसका मान लगभग 0.76 V आता है अतः अज्ञात इलेक्ट्रोड का विभव ज्ञात कर लेते हैं।
इस परिपाटी से डेनियल सेल की अर्ध अभिक्रिया को निम्न प्रकार लिखा जा सकता है।

सेल की समग्र अभिक्रिया उपरोक्त अभिक्रियाओं को योग होती है अर्थात
सेल का emf (विद्युत वाहक बल)

NOTE —
(1) प्लेटिनम और स्वर्ण जैसी धातुएं अक्रिय इलेक्ट्रोड के रूप में प्रयुक्त होती है वे अभिक्रिया में भाग नहीं लेती है परन्तु ऑक्सीकरण और अपचयन के लिए एवं इलेक्ट्रोनो के चालान के लिए अपनी सतह प्रदान करती है।
(2) ह्यड्रोजन के सापेक्ष ऑक्सीकृत और अपचयित होने की क्षमता के आधार पर सक्रियता श्रेणी बनायी जाती है ज्ञात तत्वों में लिथियम सबसे अच्छा अपचायक है क्योंकि उसका इलेक्ट्रोड विभव सबसे अधिक ऋणात्मक है तथा F सबसे अच्छा ऑक्सीकारक है क्योकि उसका इलेक्ट्रोड विभव सबसे अधिक धनात्मक है।