ईंधन सेल एवं संक्षारण (लोहे पर जंग लगने की क्रियाविधि)
ईंधन सेल (H2-O2 सेल)
जीवाश्म ईंधनों को जलाकर इनकी ऊर्जा से जल को उच्च दाब वाली भाप में बदला जाता है इस भाप से टरबाइन को घुमाकर विद्युत ऊर्जा का उत्पादन किया जाता है इस प्रक्रिया में बहुत अधिक वायु प्रदूषण होता है अतः विद्युत ऊर्जा बनाने का यह कोई अच्छा तरीका नहीं है।
विद्युत रसायन में बिना किसी प्रदूषण के रासायनिक ऊर्जा को विद्युत ऊर्जा में बदल सकते हैं अतः उनके द्वारा प्रदूषण नहीं होने के कारण यह विद्युत उत्पादन का अच्छा तरीका है इसी गुण का उपयोग करके ईंधन सेल बनाए जाते हैं। ईंधन सेलो में H2, O2, CH4, CH3OH, CH3CH2OH आदि की रासायनिक ऊर्जा को बिना किसी प्रदूषण के विद्युत ऊर्जा में बदला जा सकता है अपोलो अभियान में H2 व O2 पर आधारित ईंधन सेल काम में लिया गया था इस ईंधन सेल में उत्पाद के रूप में बनी जलवाष्प को संघनित करके अंतरिक्ष यात्रियों के पीने के काम में लिया गया।
ईंधन सेल की बनावट
इस ईंधन सेल में कार्बन के रन्ध्रमय दो इलेक्ट्रोड होते हैं इन इलेक्ट्रोडो के मध्य सांद्र जलीय NaOH का विलयन भरा होता है। इस सेल में रासायनिक ईंधन H2 व O2 को लगातार इलेक्ट्रोडो पर उपलब्ध कराया जाता है तथा उत्पादों को हटाते रहते हैं इसलिए यह लगातार विद्युत का उत्पादन करता रहता है।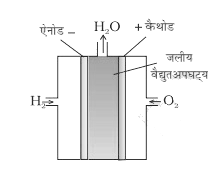
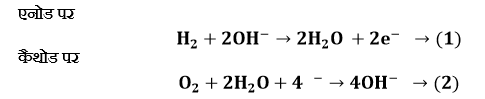
समीकरण (1) को 2 से गुणा करके समीकरण (2) से जोड़ने पर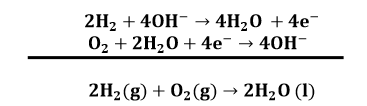
H2O2 सेल की विशेषताएं
- उत्पाद में केवल जल , जो प्रदूषण नहीं फैलाता है।
- लगातार H2 व O2 प्रवाहित करने से विद्युत ऊर्जा प्राप्त होती है।
- यह सेल जटिल नहीं होता है रखरखाव में आसानी।
संक्षारण
कई प्रकार की धातुओं से बनी वस्तुएं वायुमंडलीय ऑक्सीजन ,जलवाष्प आदि से क्रिया करके अपनी सतह से टूट-टूटकर हटती रहती है इसे संक्षारण कहा जाता है।
सामान्य लक्षण :- 1.लोहे पर जंग लगना 2.चांदी के रंग में कालापन आ जाना 3. पीतल व तांबे पर हरे रंग की परत का चढ़ना
संक्षारण की वजह से लाखों करोड़ों रुपयों का नुकसान होता है संक्षारण में धातुओं पर सामान्यतः ऑक्साइड की परत चढ़ जाती है, धातु की सतह पर धातु ऑक्साइडों का निर्माण होता है।
लोहे पर जंग लगने की क्रियाविधि

लोहे की जिस सतह पर इसका ऑक्सीकरण होता है एनोड का कार्य करती है।
![]()
इस प्रकार निकले हुए इलेक्ट्रॉन धातु में गति करते हुए उस स्थान पर जाते हैं जहां H+ आयन उपलब्ध होते हैं कार्बोनिक अम्ल (H2O+ CO2 = H2CO3) एवं H2O से H+ आयन प्राप्त होते हैं H+ आयनो की उपस्थिति में ये इलेक्ट्रॉन ऑक्सीजन का अपचयन करते हैं व सतह कैथोड का कार्य करती है।
![]()
फेरस आयन वायुमंडलीय ऑक्सीजन से जल की उपस्थिति में क्रिया करके ऑक्सीकृत हो जाते हैं और फेरिक ऑक्साइड बनाते हैं और H+ आयन भी बनते हैं।![]() फेरिक ऑक्साइड तथा जल से जंग का निर्माण होता है।
फेरिक ऑक्साइड तथा जल से जंग का निर्माण होता है।![]()
कुछ दिनों पश्चात जंग धातु की सतह से नीचे गिर जाती है इसके पश्चात धातु की सतह पर पुनः जंग लगना प्रारंभ हो जाता है।
संक्षारण रोकने के उपाय
- धातु की सतह पर पेंट करके
- धातु की सतह पर ग्रीस या तेल का लेप करके
- यदि कम क्रियाशील धातु पर अधिक क्रियाशील धातु की परत चढ़ा दी जाती है तो अधिक क्रियाशील धातु का ही संक्षारण होता है कम क्रियाशील का नहीं।
- भूमिगत लोहे के पाइपों के साथ अधिक क्रियाशील धातु मैग्नीशियम को जोड़ दिया जाता है तो इसमें मैग्नीशियम धातु का संक्षारण होता है Fe का नहीं होता है क्योंकि मैग्नीशियम धातु अधिक क्रियाशील होने से एनोड का कार्य करती है तथा Fe धातु कैथोड का कार्य करती है।
नोट – अधिक क्रियाशील का अर्थ अधिक अच्छे अपचायक जिसका अपचयन विभव कम होगा धातु उतना ही सक्रिय होगा ।
धन्यवाद गुरु जी🙏🙏
Sir your notes are in very simple and precise language
thanks guru ji 🙏🙏