धातुकर्म का विद्युतरासायनिक सिद्धांत
(ऑक्सीकरण अपचयन अभिक्रिया)
ΔGϴ = -nfEϴ
अधिक क्रियाशील धातुओं का मानक इलेक्ट्रोड विभव ऋणात्मक होता है। अतः उनके लिए ΔG धनात्मक आएगा तथा उनका अपचयन आसान नहीं होगा दो अलग-अलग धातुओं के लवणों में उनके इलेक्ट्रोड लगाकर गैल्वेनिक सेल बनाए जाते हैं इस प्रकार के सेल में ΔG ऋणात्मक आता है और अधिक क्रियाशील धातु के द्वारा कम क्रियाशील धातु का अपचयन कर दिया जाता है।
Fe(s) + 2Cu2+ (aq) → 2Cu(s) + Fe2+
अधातुओ को मुख्यतः लवणों के जलीय विलयन के विद्युत अपघटन दवारा प्राप्त करते है जिनमें ऑक्सीकरण क्रिया के द्वारा अधातु प्राप्त करते हैं।
उदाहरण – जलीय सोडियम क्लोराइड का विद्युत अपघटन करने से Cl2 ,H2 व NaOH प्राप्त होते हैं।
एल्यूमिना (Al2O3) से एल्यूमीनियम का निष्कर्षण (होल हेराल्ट प्रक्रम)
इसके धातुकर्म में शुद्ध Al2O3 में Na3AlF6 ,CaF2 मिलाते है जिससे गलनांक कम व चालकता आ जाती है एनोड के रूप में ग्रेफाइट व कैथोड के रूप में कार्बन की परतयुक्त स्टील का पात्र होता है गलित अधात्री का विद्युत अपघटन किया जाता है इसमें एनोड पर उत्सर्जित ऑक्सीजन गैस कार्बन से अभिक्रिया करके कार्बन मोनोऑक्साइड तथा कार्बन डाई ऑक्साइड बनाती है।
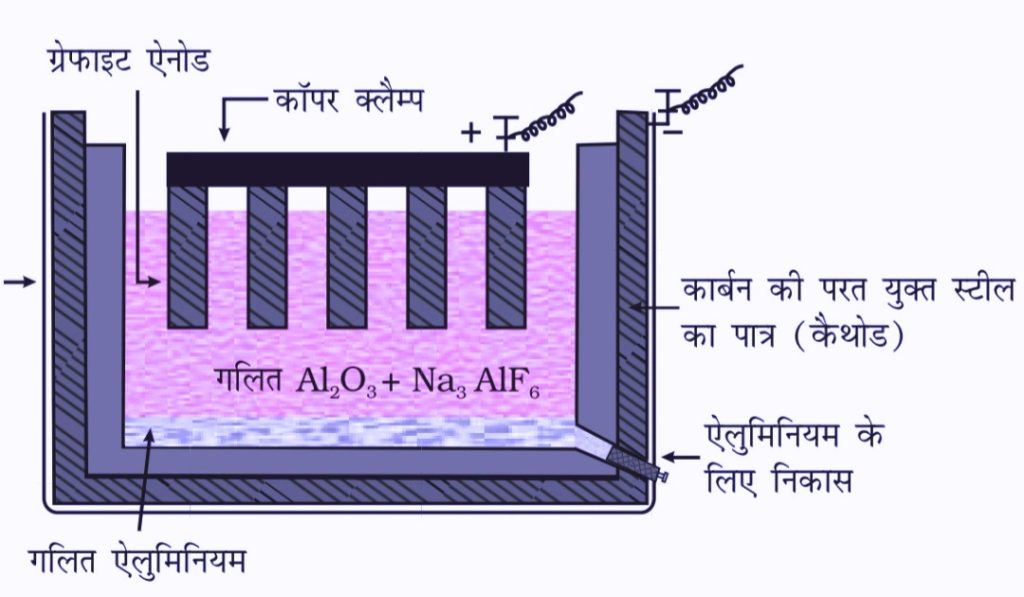
1Kg Al के लिए 0.5 कार्बन जल जाता है।
अभिक्रियाएं
एनोड पर
C(s) + O2- (गलित) → CO + 2e–
C(s) + 2O2- (गलित) → CO2 + 4e–
कैथोड पर
Al3+ (गलित) +3e– → Al(l)
सम्पूर्ण अभिक्रिया 2Al2O3 + 3C → 4Al + 3CO2
निम्न कोटि अयस्कों तथा रद्दी धातु से कॉपर प्राप्त करना
निम्न कोटि अयस्को से कॉपर का निष्कर्षण हाइड्रो धातुकर्म द्वारा किया जाता है Cu2+ आयन युक्त विलयन की रद्दी लोहे या हाइड्रोजन से क्रिया कराते हैं ।
Cu2+(aq) + H2(g) → Cu(S) + 2H+ (aq)
Cu2+(aq) + Fe(s) → 2Cu(s) + Fe2+(aq)
धातुकर्म का विद्युतरासायनिक सिद्धांत