नेर्नस्ट समीकरण (NERNST EQUATION)
अभी तक ज्ञात किए गए इलेक्ट्रोड विभव स्पीशीज की 1M सांद्रता के लिए ज्ञात किए हैं जिन्हें मानक इलेक्ट्रोड विभव कहा जाता है। वैज्ञानिक नेर्नस्ट ने स्पीशीज कि किसी भी सांद्रता के लिए इलेक्ट्रोड विभव ज्ञात करने के लिए समीकरण दिया जिसे नेर्नस्ट (NERNST) समीकरण कहते हैं एक इलेक्ट्रोड जिस पर निम्न अभिक्रिया होती है तो इसके लिए (NERNST) समीकरण को निम्न प्रकार प्रदर्शित करते हैं।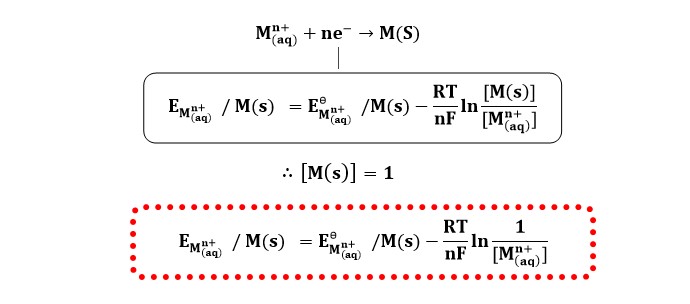 यहाँ :-
यहाँ :-
R = गैस नियतांक = 8.314 जूल मोल-1 केल्विन-1
T = तापमान = 298 k
n = स्थानांतरित इलेक्ट्रॉन
F = फैराडे नियतांक = 96487 कुलाम/ मोल अर्थात 96500 कुलाम/ मोल
lnx = 2.303log10
एक मोल इलेक्ट्रोनो पर उपस्थित कुल आवेश को फैराडे नियतांक कहा जाता है इसका मान 96487 कुलाम/ मोल अर्थात 96500 कुलाम/ मोल होता है।
नेर्न्स्ट (NERNST) समीकरण व्युत्पित
![]()
इस अभिक्रिया में मुक्त ऊर्जा को उष्मागतिकी के आधार पर साम्य स्थिरांक से निम्न प्रकार सम्बंधित किया गया है।

यदि क्रियाफल व क्रियाकारक की सांद्रता इकाई हो तो सेल का विभव (E) मानक सेल विभव (Eϴ) के सेल बराबर होता है।