
इलेक्ट्रोड विभव,मानक इलेक्ट्रोड विभव,सेल विभव,मानक सेल विभव,मानक इलेक्ट्रॉड विभव (SHE)
1.इलेक्ट्रोड विभव – धातु एवं उसके आयनों के मध्य उत्पन्न हुए विभव को इलेक्ट्रोड विभव कहते हैं (धातु की छड़ व विलयन) इलेक्ट्रोड विभव दो प्रकार का होता है।
ऑक्सीकरण इलेक्ट्रोड विभव Zn(S) → Zn+2(aq) +2e–
अपचयन इलेक्ट्रोड विभव Cu+2(aq) +2e– →–Cu(S)
गैल्वेनिक सेल बनाते समय अधिक सक्रिय धातु का एनोड और कम सक्रिय धातु का कैथोड बनाया जाता है। अधिक सक्रिय धातु का मानक अपचयन विभव अधिक ऋणात्मक होता है।
2.मानक इलेक्ट्रोड विभव – जब सेल में प्रयुक्त सभी स्पीशीज की सांद्रता 1M होती है तब इलेक्ट्रोड विभव को मानक इलेक्ट्रोड विभव कहा जाता है IUPAC के नियमानुसार मानक अपचयन विभव को ही मानक इलेक्ट्रॉड विभव माना जाता है।
सेल विभव (सेल का विद्युत वाहक बल)
3.सेल विभव – गैल्वेनिक सेल में प्रयुक्त एनोड व कैथोड के इलेक्ट्रोड के विभव में अंतर को सेल विभव कहा जाता है इसे हम Ecell से प्रदर्शित करते हैं।
4.मानक सेल विभव – जब सेल में प्रयुक्त सभी स्पीशीज की सांद्रता 1M होती है उस समय सेल विभव को मानक सेल विभव कहा जाता है इसे Eϴcell से प्रदर्शित करते हैं।
सेल का प्रदर्शन
IUPAC नियमानुसार एनोड हमेशा बाई तरफ तथा कैथोड को दाई तरफ प्रदर्शित करते हैं इलेक्ट्रोड और विद्युत अपघट्य को अलग-अलग प्रदर्शित करने के लिए दोनों के बीच में एक लाइन खींचते हैं तथा लवण सेतु को प्रदर्शित करने के लिए दो रेखाएं खींचते हैं।
उदाहरण -डेनियल सेल का प्रदर्शन
Zn(S)|Zn+2(aq) ||Cu+2(aq)|Cu(S)
सेल विभव की गणना – IUPAC के नियमानुसार कैथोड के इलेक्ट्रोड विभव में से एनोड के इलेक्ट्रोड विभव को घटाकर Ecell की गणना करते हैं।
Ecell = ER – EL
इस परिपाटी के अनुसार सेल विभव हमेशा धनात्मक आता है।
मानक सेल विभव की गणना –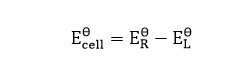
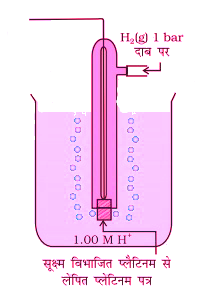
मानक हाइड्रोजन इलेक्ट्रोड (SHE) – इस इलेक्ट्रोड के लिए इलेक्ट्रोड विभव का मान शून्य आता है इसमें एक प्लेटिनम का इलेक्ट्रोड होता है जो इलेक्ट्रॉन स्थानांतरण का कार्य करता है तथा अक्रियाशील होने के कारण सेल अभिक्रिया में भाग नहीं लेता है। इसे विद्युत अपघट्य में डुबोकर रखते हैं इसके चारों और एक नली लगी होती है। जिसके सिरे पर सूक्ष्म विभाजित प्लेटिनम से लेपित प्लेटिनम पत्र होता है जोकि छिद्र युक्त होता है और इसमें से होकर हाइड्रोजन गैस अपघट्य में आती है। इस अपघट्य में हाइड्रोजन का दाब 1 बार तथा अपघट्य में H+ आयनों की सांद्रता स्थिर बनाकर रखी जाती है।
सेल का प्रदर्शन 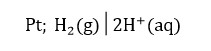
Very good.