विद्युतअपघटन से सम्बंधित फैराडेनियम
विद्युत अपघटन से सम्बंधित फैराडे के नियम (प्रथम एवं द्वितीय)
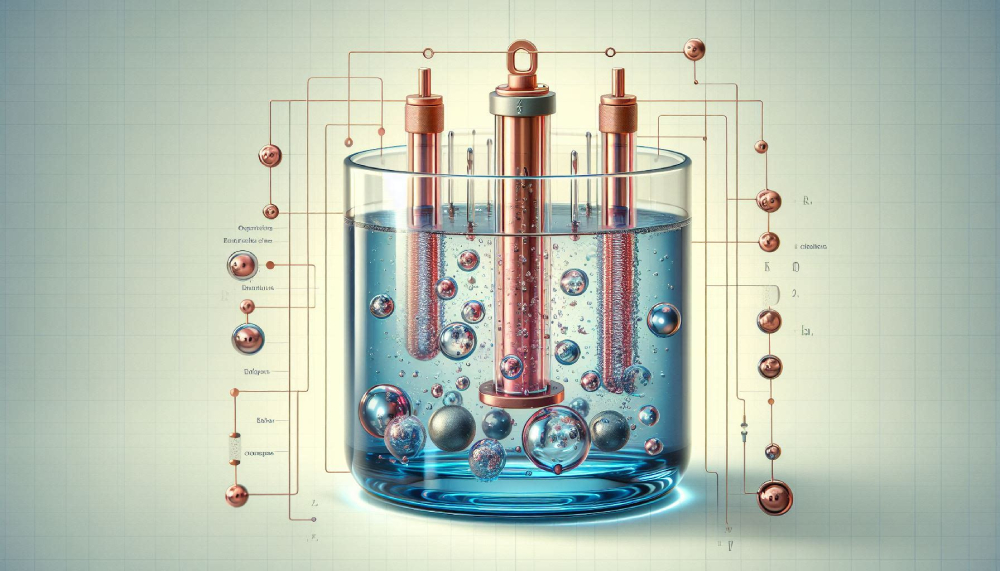
विद्युत अपघटनी सेल
इस प्रकार के सेलों में बाह्य विभव या विद्युत का स्रोत लगाकर सेल में अपघटन क्रियाएँ संपन्न करायी जाती है। इस प्रकार के सेल में एक पात्र में विद्युत अपघट्य का विलयन भरा होता है तथा इसमें दो इलेक्ट्रोड लगे होते है जिन्हें एनोड और कैथोड कहते है इन्हें बाह्य विद्युत स्रोत से क्रमशः स्रोत के धनाग्र तथा ऋणाग्र से जोड़ते है।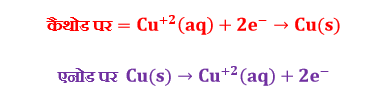
इसमें विद्युत धारा प्रवाहित करने पर एनोड से धातु आयन टूटकर विलयन में आएंगे तथा विलयन से धातु धीरे धीरे कैथोड पर जमा हो जायेंगी।
NOTE – इस प्रकार के सेलो का उपयोग धातुकर्म में उच्च कोटि की शुद्ध धातु प्राप्त करने में किया जाता है अनेक प्रकार के धातु Na, Mg, Al आदि को इनको लवणों से विद्युत अपघटन द्वारा पृथक करने के लिए इन सेलो का उपयोग किया जाता है।
विद्युत अपघटन से सम्बंधित फैराडे के नियम
1.फैराडे का प्रथम नियम – इसके अनुसार विद्युत अपघटन की प्रक्रिया में इलेक्ट्रोडो पर अपघटित या निक्षेपित पदार्थो की मात्राएँ सेल में प्रवाहित की गई धारा के समानुपाती होती है । धारा की मात्रा को प्रवाहित कुल आवेश की मात्रा के रूप में देखा जाता है यदि I धारा t समय तक प्रवाहित हो तो कुल आवेश की मात्रा Q = It है ।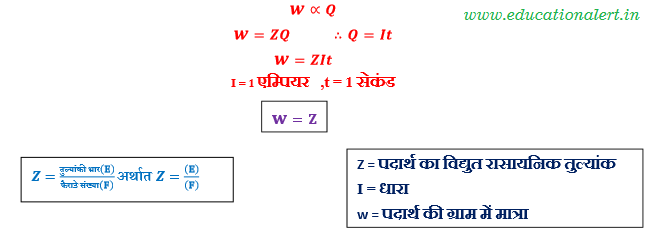
2.फैराडे का द्वितीय नियम –
यदि दो अलग अलग प्रकार के विद्युत अपघट्यों युक्त विद्युत अपघटनी सेलो में समान मात्रा में धारा प्रवाहित की जाये तो इलेक्ट्रोडो (कैथोड) पर अपघटित अथवा निक्षेपित पदार्थो की मात्राएँ उनके तुल्यांकी द्रव्यमानो के समानुपाती होती है।
अपघटित अथवा निक्षेपित पदार्थो की मात्राओं को एनोड और कैथोड पर होने वाली अभिक्रिया की संतुलित समीकरण से ज्ञात किया जाता है।

उपरोक्त समीकरण से स्पष्ट है कि कैथोड पर एक मोल सिल्वर के निक्षेपण के लिए एक मोल इलेक्ट्रॉनों की आवश्यकता है एक मोल इलेक्ट्रॉनों पर उपस्थित कुल आवेश को फैराडे नियतांक कहा जाता है । इसका मान 96487 या 96500 C mol-1 होता है।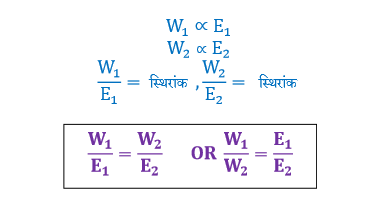
उदाहरण – एक Na मोल या 23 gm Na इलेक्ट्रोड पर मुक्त करने के लिए 1 मोल इलेक्ट्रॉनों का विनिमय होता है अर्थात 1 मोल इलेक्ट्रॉनों की आवश्यकता होगी NOTE– विद्युत अपघट्य के उत्पाद निम्न कारकों पर निर्भर करते हैं।
NOTE– विद्युत अपघट्य के उत्पाद निम्न कारकों पर निर्भर करते हैं।
1.विद्युत अपघट्य की प्रकृति – विद्युत अपघट्य को गलित अवस्था में अथवा इनका जलीय विलियन लेने पर दोनों स्थितियों में अलग-अलग प्रकार के उत्पाद प्राप्त कर सकते हैं।
2.इलेक्ट्रोड की प्रकृति – अक्रिय इलेक्ट्रोड सेल अभिक्रिया में भाग नहीं लेते हैं और सिर्फ इलेक्ट्रॉन स्थानांतरण का काम करते हैं जबकि सक्रिय इलेक्ट्रोड वे होते हैं जो सेल अभिक्रिया में भी भाग लेते हैं अतः अक्रिय व सक्रिय इलेक्ट्रोडो की उपस्थिति में अलग-अलग उत्पाद प्राप्त हो सकते हैं।
EXAMPLE – सोडियम क्लोराइड गलित का विद्युत अपघटन
गलित सोडियम क्लोराइड का विद्युत अपघटन करने पर अपघट्य में सिर्फ दो ही आयन उपस्थित है Na+ तथा Cl– अतः जब धारा प्रवाहित करेंगे तो Na+ आयन कैथोड की ओर तथा Cl– आयन एनोड की ओर गति करेंगे तथा इन इलेक्ट्रोडो पर निम्न प्रकार से उत्पाद प्राप्त होंगे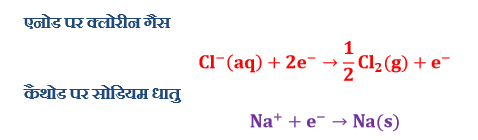
EXAMPLE – सोडियम क्लोराइड के जलीय विलयन का विद्युत अपघटन
जब सोडियम क्लोराइड के जलीय विलियन का विद्युत अपघटन करते हैं तो अपघट्य में Na+,Cl–, H+, OH– सभी आयन उपस्थित रहते हैं अतः एनोड पर ऑक्सीकृत एवं कैथोड पर अपचयित होने के लिए आयनों के मध्य प्रतिस्पर्धा रहेगी
कैथोड पर अभिक्रिया – कैथोड पर Na+ तथा H+, आयनों के मध्य अपचयित होने के लिए प्रतिस्पर्धा रहती है वास्तव में अपचयन उसी आयन या तत्व का होता है जिसके लिए अपचयन विभव का मान ज्यादा होता है।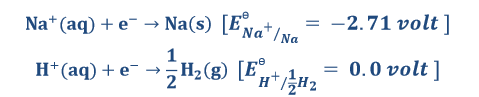 हाइड्रोजन आयनों के लिए अपचयन विभव का मान ज्यादा है इसलिए कैथोड पर इन्हीं का अपचयन होगा।
हाइड्रोजन आयनों के लिए अपचयन विभव का मान ज्यादा है इसलिए कैथोड पर इन्हीं का अपचयन होगा। लेकिन कैथोड पर निम्न अभिक्रिया भी होती है जल के वियोजन द्वारा H+ उत्पन्न होता है।
लेकिन कैथोड पर निम्न अभिक्रिया भी होती है जल के वियोजन द्वारा H+ उत्पन्न होता है।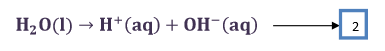 समीकरण 1 व 2 को जोड़कर कैथोड पर होने वाली कुल अभिक्रिया प्राप्त की जाती है।
समीकरण 1 व 2 को जोड़कर कैथोड पर होने वाली कुल अभिक्रिया प्राप्त की जाती है।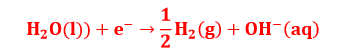 एनोड पर अभिक्रिया – एनोड पर भी क्लोरीन तथा ऑक्सीजन के ऑक्सीकृत होने के लिए प्रतिस्पर्धा रहेगी तथा निम्न दो अभिक्रिया होने की संभावना है।
एनोड पर अभिक्रिया – एनोड पर भी क्लोरीन तथा ऑक्सीजन के ऑक्सीकृत होने के लिए प्रतिस्पर्धा रहेगी तथा निम्न दो अभिक्रिया होने की संभावना है।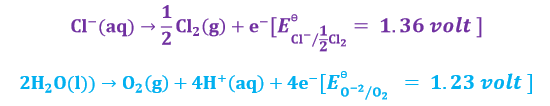
एनोड पर उस तत्व का ऑक्सीकरण होगा जिसकी ऑक्सीकृत होने की प्रवृत्ति ज्यादा होगी अर्थात जिसके लिए अपचयन विभव (मानक इलेक्ट्रोड विभव) कम होगा उपरोक्त दोनों अभिक्रियाओं में ऑक्साइड आयनों के लिए अपचयन विभव कम है अतः एनोड पर इन्हीं का एनोड ऑक्सीकरण होना चाहिए लेकिन ऑक्साइड आयनों के ऑक्सीकरण के लिए हमें और अधिक अतिरिक्त विभव (अधिविभव) लगाना पड़ेगा जो अभिक्रियाओं को ओर बहुत जटिल बना देगा । इसलिए अधिविभव की अनुपस्थिति में एनोड पर क्लोराइड आयनों का ही ऑक्सीकरण होगा तथा निम्न अभिक्रिया होगी।
लेकिन एनोड पर निम्न अभिक्रिया भी होगी
एनोड पर कुल अभिक्रिया तथा कैथोड पर कुल अभिक्रिया को जोड़कर समग्र सेल अभिक्रिया प्राप्त की जाती है। (उपरोक्त तीनों समीकरण को जोड़ने पर)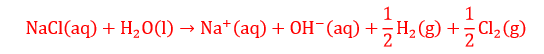
सोडियम क्लोराइड का हाइड्रोलाइसिस करने पर सोडियम हाइड्रोक्साइड बनने के कारण pH धीरे-धीरे बढ़ती जाती है अर्थात विलयन क्षारीय होता जाता है।

विद्युतअपघटन से सम्बंधित फैराडेनियम