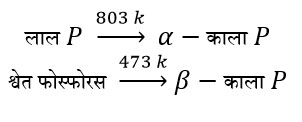नाइट्रोजन के ऑक्साइड
- N2O (ऑक्सीकरण अंक = +1) डाई नाइट्रोजन ऑक्साइड
विधि – NH4NO3 → N2O + 2H2O

- NO (ऑक्सीकरण अंक = +2) नाइट्रोजन मोनो ऑक्साइड
विधि – 2NaNO2 + 2FeSO4 + 3H2SO4 → Fe2(SO4)3 + 2NaHSO4 + 2NO + 2H2O
![]()
अयुग्मित इलेक्ट्रॉन गतिशील – अनुचुम्बकीय
- N2O3 (ऑक्सीकरण अंक = +3) डाई नाइट्रोजन ट्राईऑक्साइड
विधि – 2NO + N2O4 → 2N2O3 (तापमान – 250 k)

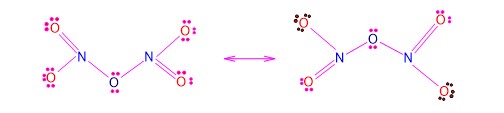
- NO2 (ऑक्सीकरण अंक = +4) नाइट्रोजन डाई ऑक्साइड
विधि – 2Pb(NO3)2 → 4NO2 + 2PbO +O2
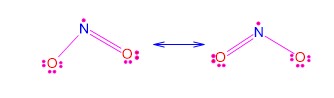
NO2 का द्वितयिकरण – NO2 में संयोजकता इलेक्ट्रॉन विषम संख्या में होते है इसमें अष्टक नियम असफल रहता है द्वितयन होने पर यह N2O4 अणु में बदल जाता है व इसमें अष्टक नियम का पालन होता है।
2NO2 (गैस) → N2O4 (ठोस) (ठंडा करने पर)
- N2O4 (ऑक्सीकरण अंक = +4) डाई नाइट्रोजन टेट्रा ऑक्साइड
विधि – 2NO2 (गैस) → N2O4 (ठोस) (ठंडा करने पर)

- N2O5 (ऑक्सीकरण अंक = +5) डाई नाइट्रोजन पेन्टा ऑक्साइड
विधि – 4HNO3 +P4O10 → 4HPO3 + 2N2O5
फोस्फोरस के अपररूप
| श्वेत फोस्फोरस | लाल फोस्फोरस | काला फोस्फोरस | |
|
|
श्वेत मोमी पारभासी ठोस
विषैला जल में अविलेय , CS2 में विलेय चतुष्फलकीय P4 इकाइयां 600 बंध कोण होने की वजह से वलय में अधिक तनाव अतः कम स्थाई व अति क्रियाशील लहसून जैसी गंध व हवा में आग पकड़ लेता है व P4O10 का सफ़ेद धुंआ देता है P4 + 5O2 → P4O10 यह फोस्फोरस अँधेरे में चमकता है तथा इस फोस्फोरस कों जल में रखा जाता है
|
लोहे जैसी धूसर चमक
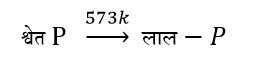
अविषैला जल में अविलेय , CS2 में अविलेय चतुष्फलकीय P4 श्रंखलाबद्ध बंध कोण 1000 होने के कारण सफ़ेद Pकी तुलना में अधिक स्थाई तथा कम क्रियाशील कोई गंध नही श्वेत फोस्फोरस कों 573 k ताप पर कई दिनों तक गर्म करने से लाल फोस्फोरस बनता है
|
अपारदर्शी ठोस
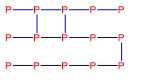
अविषैला जल में अविलेय , CS2 में अविलेय परतदार सरंचना यह अधिक स्थाई व कम क्रियाशील होता है कोई गंध नही दो अपररूप α व β
|