पौटेशियम परमेग्नेट विधि अभिक्रियाएं
पौटेशियम परमेग्नेट बनाने की विधि एवं उसके रासायनिक अभिक्रियाएं
पौटेशियम परमेग्नेट (KMnO4)
बनाने की विधि
1.पायरोलुसाइट (MnO2) एवं KOH को वायु की उपस्थिति में गर्म करने पर हरे रंग के पौटेशियम मैग्नेट में परिवर्तित हो जाता है ।
2MnO2 +4KOH +O2 → 2K2MnO4+2H2O
पौटेशियम मैग्नेट से पौटेशियम परमेग्नेट प्राप्त करने की विधियाँ
अम्लीय उदासीन माध्यम में पौटेशियम मैग्नेट असमानुपातित होकर पौटेशियम परमैग्नेट में परिवर्तित हो जाता है ।
3K2MnO4 + 4HCl → KMnO4 + MnO2 +4KCl + 2H2O
OR
3MnO42- + 4H+ → 2MnO4– + MnO2 + 2H2O
पौटेशियम मैग्नेट का क्षारीय माध्यम मे विद्युत अपघटनी ऑक्सीकरण करने पर पौटेशियम परमैग्नेट प्राप्त होता है ।
MnO42- → MnO4– + e–
प्रयोगशाला मे मैंगनीज (II) आयन के लवण का परऑक्सोडाईसल्फेट द्वारा ऑक्सीकरण करने पर पौटेशियम परमैंगनेट (MnO4–) बनता है ।
2Mn2++5S2O82- + 8H2O → 2MnO4– +10SO42- +16H+
गुण :-
- KMnO4 के काले बैंगनी या गहरे बैंगनी रंग के क्रिस्टल होते हैं ।
- यह ठंडे जल में कम विलेय तथा गर्म जल में अधिक विलय होता है ।
- उच्च ताप (573k) पर KMnO4 का अपघटन हो जाता है ।
- यह प्रबल ऑक्सीकारक पदार्थ है यह अम्लीय,क्षारीय एवं उदासीन माध्यम में भिन्न भिन्न प्रकार से ऑक्सीकरण करता है तथा अपचयन भी इसका भिन्न – भिन्न प्रकार से होता है ।
अम्लीय माध्यम में पौटेशियम परमैग्नेट का अपचयन
2KMnO4 + 8H2SO4 → K2SO4 + 2MnSO4 + 3H2O + 5[O]
आयनिक अभिक्रिया MnO4– + 8H+ + 5e– → Mn2+ + 4H2O
अम्लीय माध्यम में पौटेशियम परमैग्नेट निम्न पदार्थों का ऑक्सीकरण कर देता है ।
1. फेरस सल्फेट को फेरिक सल्फेट में ऑक्सीकृत कर देता है ।
MnO4– + 8H+ + 5e– → Mn2+ + 4H2O
5Fe2+ → 5Fe3+ + 5e–
जोड़ने पर MnO4– + 8H+ + 5Fe2+ → Mn2+ + 4H2O + 5Fe3+
2.पौटेशियम आयोडाइड के विलयन को आयोडीन में ऑक्सीकृत कर देता है ।
2MnO4– + 16H+ + 10e– → 2Mn2+ + 8H2O
10I– → 5I2 + 10e–
जोड़ने पर 2MnO4– + 16H+ + 10I– → 2Mn2+ + 8H2O +5I2
3.यह H2S को सल्फर में ऑक्सीकृत कर देता है ।
2MnO4– + 16H+ + 10e– → 2Mn2+ + 8H2O
5S2- → 5S + 10e–
जोड़ने पर 2MnO4– + 16H+ + 5S2- → 2Mn2+ + 8H2O + 5S
4.यह ऑक्सेलिक अम्ल को कार्बनडाइऑक्साइड में ऑक्सीकृत कर देता है ।
2MnO4– + 16H+ + 10e– → 2Mn2+ + 8H2O
5C2O42- → 10CO2 + 10e–
जोड़ने पर 2MnO4– + 16H+ + 5C2O42- → 2Mn2+ + 8H2O + 10CO2
5.यह सल्फ्युरस अम्ल कों सल्फ्यूरिक अम्ल में अथवा सल्फाइट को सल्फेट में ऑक्सीकृत कर देता है ।
2MnO4– + 16H+ + 10e– → 2Mn2+ + 8H2O
5SO32- + 5H2O → 5SO42- + 10H+ + 10e–
जोड़ने पर 2MnO4– + 6H+ + 5SO32- → 2Mn2+ + 3H2O + 5SO42-
6.यह नाइट्रस अम्ल को नाइट्रिक अम्ल में या नाइट्राइट को नाइट्रेट में ऑक्सीकृत कर देता है ।
2MnO4– + 16H+ + 10e– → 2Mn2+ + 8H2O
5NO2– + 5H2O → 5NO3– +10H+ + 10e–
जोड़ने पर 2MnO4– + 6H+ + 5NO2– → 2Mn2+ + 3H2O + 5NO3–
KMnO4 का उदासीन या क्षारीय माध्यम मे अपचयन
2KMnO4 + H2O → 2MnO2 + 2KOH + 3[O]
आयनिक अभिक्रिया
2MnO4– + H2O → 2MnO2 + 2OH– + 3[O]
उदासीन या क्षारीय माध्यम में KMnO4 निम्न पदार्थों का ऑक्सीकरण कर देता है ।
- यह KI के विलयन को KIO3 मे ऑक्सीकृत कर देता है ।
2MnO4– +H2O → 2MnO2 +2OH– +3[O]
KI + 3[O] → KIO3
जोड़ने पर – 2MnO4– + H2O + KI → 2MnO2 + 2OH– + KIO3
2. यह मैग्नस लवण को MnO2 में ऑक्सीकृत कर देता है यह ZnSO4 या ZnO द्वारा उत्प्रेरित होती है ।
2MnO4– + H2O → 2MnO2 + 2OH– + 3[O]
3Mn++ + 3[O] + 3H2O → 2MnO2 + 6H+
जोड़ने पर – 2MnO4– + 5H2O + 3Mn++ → 4MnO2 + 2OH– + 6H+
3. यह थायोसल्फेट (S2O32-) को सल्फेट में ऑक्सीकृत कर देता है ।
8MnO4– + 4H2O → 8MnO2 + 8OH– + 12[O]
S2O32-+ 12[O] + 3H2O → 6SO42- + 6H+
जोड़ने पर – 8MnO4– + 7H2O + S2O32- → 8MnO2 + 6SO42- + 8OH– + 6H+
8MnO4– + H2O + S2O32- → 8MnO2 + 6SO42- + 2OH–
परमैग्नेट आयन MnO4– 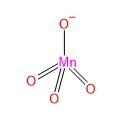
मैग्नेट आयन MnO42-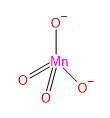











2 Comments