f समुदाय के तत्व
लैंथेनाइड (58-71) एवं एक्टिनाइड (90-103) तत्वों को f- ब्लॉक के तत्व कहते हैं क्योंकि इनका अंतिम इलेक्ट्रॉन f- उपकोश मे जाता है इनको संक्रमण तत्वों के मध्य से निकालकर आवर्त सारणी के नीचे दो श्रेणियों में रखा गया है इसलिए इनको आंतरिक संक्रमण तत्व भी कहते हैं प्रारंभ में ये तत्व दुर्लभ खनिजों से मृदाओं (ऑक्साइडो) के रूप में प्राप्त किए गए इसलिए इनको दुर्लभ मृदा तत्व भी कहते हैं ।
लैंथेनाइड
लैंथेनम के बाद आते हैं इस कारण इनको लैंथेनाइड तत्व कहते हैं लैंथेनाइड तत्वों को लैंथेनॉन (Ln) भी कहते हैं ।
गुण :-
- इलेक्ट्रॉनिक विन्यास – इनके बाहरी कोशो का सामान्य इलेक्ट्रॉनिक विन्यास (n-2)f1-14 (n-1)d0-1 ns2 अर्थात 4f ,5d ,6s2 प्रकार का होता है ।
| क्र.स. | परमाणु क्रमांक | नाम | संकेत | इलेक्ट्रोनिक विन्यास | ऑक्सीकरण अवस्था |
| 0 | 57 | लैंथेनम | La | 4f0,5d1,6s2 | +3 |
| 1 | 58 | सीरियम | Ce | 4f1,5d1,6s2 | +3,+4 |
| 2 | 59 | प्रोजियोडिमियम | Pr | 4f3,5d0,6s2 | +3,+4 |
| 3 | 60 | नियोडिमियम | Nd | 4f4,5d0,6s2 | +2,+3,+4 |
| 4 | 61 | प्रोमिथियम | Pm | 4f5,5d0,6s2 | +3 |
| 5 | 62 | समेरियम | Sm | 4f6,5d0,6s2 | +2,+3 |
| 6 | 63 | युरोपियम | Eu | 4f7,5d0,6s2 | +2,+3 |
| 7 | 64 | गैडोलिनियम | Gd | 4f7,5d1,6s2 | +3 |
| 8 | 65 | टर्बियम | Tb | 4f9,5d0,6s2 | +3,+4 |
| 9 | 66 | डिस्प्रोसियम | Dy | 4f10,5d0,6s2 | +3 |
| 10 | 67 | होलियम | Ho | 4f11,5d0,6s2 | +3 |
| 11 | 68 | अर्बियम | Er | 4f12,5d0,6s2 | +3 |
| 12 | 69 | थुलियम | Tm | 4f13,5d0,6s2 | +2,+3 |
| 13 | 70 | यटर्बियम | Yb | 4f14,5d0,6s2 | +2,+3 |
| 14 | 71 | ल्युटीशियम | Lu | 4f14,5d1,6s2 | +3 |
- परमाणु आकार
जब लैंथेनाइड तत्वों में बाएं से दाएं चलते हैं तो इनके आकार में कमी होती है ।
कारण – लैंथेनाइड तत्वों का सामान्य इलेक्ट्रॉनिक विन्यास (n-2)f1-14 (n-1)d0-1 ns2 प्रकार का होता है जब तत्वों के परमाणु क्रमांक बढ़ते हैं तो बाहरी कोश में इलेक्ट्रॉन भी जुड़ते हैं परंतु कोश की संख्या समान रहती है अतः एक परमाणु क्रमांक बढ़ने तथा एक इलेक्ट्रॉन जुड़ने से प्रभावी नाभिकीय आवेश में लगभग 0.65 की वृद्धि हो जाती है इनमें नया जोड़ने वाला इलेक्ट्रॉन (n-2)f मे जाता है जो नाभिक के निकट होने से ns उपकोश के इलेक्ट्रॉन को प्रतिकर्षित नहीं कर पाता है अर्थात नाभिक व ns के इलेक्ट्रॉन के मध्य जो आकर्षण होता है उसके मध्य परिरक्षण का कार्य नहीं करता इससे नाभिक का ns के इलेक्ट्रॉन पर आकर्षण बढ़ जाता है इसलिए इनके आकार में कमी होती है जिसे लैंथेनाइड संकुचन कहते हैं ।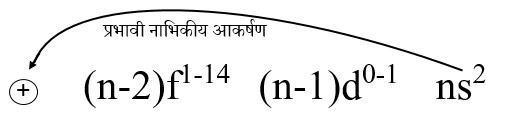 लैंथेनाइड तत्वों में बाएं से दाएं चलने पर आकार में कमी होती है परंतु Eu एवं Yb का आकार बड़ा होता है क्योंकि +2 ऑक्सीकरण अवस्था f7 एवं f14 (स्थाई इलेक्ट्रॉनिक विन्यास) के कारण होती है अतः धात्विक बंध बनाने में दो ही इलेक्ट्रॉन भाग लेते हैं जबकि अन्य तत्वों में 3 इलेक्ट्रॉन भाग लेते हैं । Ce का आकार समीपवर्ती लैंथेनाइडो से छोटा होता है क्योंकि सीरियम की +4 ऑक्सीकरण अवस्था f0 के कारण स्थाई होती है इससे Ce के चार इलेक्ट्रॉन धात्विक बंध बनाने में भाग लेते हैं जिससे आकार घट जाता है लैंथेनाइड संकुचन के कारण लैंथेनाइड के गुणों मे थोड़ा अंतर आ जाता है जिनके कारण इनको आयन विनिमय रेजिन विधि द्वारा अलग कर लेते हैं ।
लैंथेनाइड तत्वों में बाएं से दाएं चलने पर आकार में कमी होती है परंतु Eu एवं Yb का आकार बड़ा होता है क्योंकि +2 ऑक्सीकरण अवस्था f7 एवं f14 (स्थाई इलेक्ट्रॉनिक विन्यास) के कारण होती है अतः धात्विक बंध बनाने में दो ही इलेक्ट्रॉन भाग लेते हैं जबकि अन्य तत्वों में 3 इलेक्ट्रॉन भाग लेते हैं । Ce का आकार समीपवर्ती लैंथेनाइडो से छोटा होता है क्योंकि सीरियम की +4 ऑक्सीकरण अवस्था f0 के कारण स्थाई होती है इससे Ce के चार इलेक्ट्रॉन धात्विक बंध बनाने में भाग लेते हैं जिससे आकार घट जाता है लैंथेनाइड संकुचन के कारण लैंथेनाइड के गुणों मे थोड़ा अंतर आ जाता है जिनके कारण इनको आयन विनिमय रेजिन विधि द्वारा अलग कर लेते हैं ।
- ऑक्सीकरण अवस्था
इनकी सामान्य ऑक्सीकरण अवस्था +3 होती है तथा असामान्य ऑक्सीकरण अवस्था +2,+4 भी होती है इनकी स्थाई ऑक्सीकरण अवस्था f0,f7 एवं f14 के कारण होती है Ce4+ तथा Tb4+ का क्रमशः 4f0 एवं 4f14 विन्यास होता है इसलिए ये तत्व +4 अवस्था प्रदर्शित करते हैं Eu तथा Yb क्रमशः Eu2+ तथा Yb2+ आयन देते है क्योंकि इनकी ऑक्सीकरण अवस्था में इनके विन्यास क्रमशः 4f7 एवं 4f14 विन्यास होते है +2 एवं +4 ऑक्सीकरण अवस्था की प्रवृत्ति सबसे अधिक स्थाई ऑक्सीकरण अवस्था +3 में परिवर्तित होने की होती है अतः +2 व +4 ऑक्सीकरण अवस्था वाले आयन इलेक्ट्रॉन ग्रहण या त्याग करके +3 ऑक्सीकरण अवस्था में परिवर्तित हो जाते हैं इसलिए Eu2+ तथा Yb2+ आयन एक अच्छे अपचायक हैं तथा Ce4+ तथा Tb4+ आयन विलयन में अच्छे ऑक्सीकारक है Ce4+/Ce3+ के E0 का मान +1.74V है अतः यह जल को ऑक्सीकृत कर सकता है परंतु अभिक्रिया की दर धीमी होती है इसलिए Ce4+ एक अच्छा विश्लेषात्मक अभिकर्मक है
नोट – कुछ तत्व ऐसे भी है जो +2 व +4 ऑक्सीकरण अवस्था प्रदर्शित करते हैं परंतु उनमें f0,f7 एवं f14 विन्यास नहीं होता है । जैसे – Pr4+,Dy4+,Nd4+,Sm2+
- सामान्य गुण
सभी लैंथेनाइड मुलायम, अघातवर्धनीय तथा तन्य होते हैं ये ऊष्मा और विद्युत के अच्छे चालक होते हैं । लैंथेनाइड के अधिकतर आयन रंगीन होते है आयनों का रंग f- कक्षक के इलेक्ट्रोन का f-f संक्रमण के कारण होता है ऐसे आयन जिनमे एक भी अयुग्मित इलेक्ट्रोन नहीं होता है वे रंगहीन होते है जैसे – Lu3+ अपवाद – Ce3+ एवं Yb3+ मे अयुग्मित इलेक्ट्रॉन होने पर भी यह रंगहीन होते हैं ऐसे आयन जिनमें अयुग्मित इलेक्ट्रॉन होते हैं वे अनुचुंबकीय तथा जिनमें नहीं होते वे प्रतिचुंबकीय होते हैं ।
अपचायक गुण – लैंथेनाइड (Ln) अपने तीन इलेक्ट्रॉन त्याग कर Ln3+ मे ऑक्सीकृत हो जाते हैं तथा अपचायक का कार्य करते हैं अतः ये तनु अम्लों से क्रिया करके हाइड्रोजन गैस देते हैं ।
Ln3+ + 6H+ → 2Ln3+ + 3H2
| जल से क्रिया | 2Ln + 6H2O → 2Ln(OH)3 +3H2 |
| हैलोजन के साथ क्रिया | 2Ln +3X2 → 2LnX3 |
| कार्बन के साथ क्रिया | Ln +2C → LnC2 |
| नाइट्रोजन के साथ | 2Ln +N2 → 2LnN |
| सल्फाइड के साथ | 2Ln +3S → Ln2S3 |
|
वायु में खुला रखने पर ऑक्सीकृत हो जाते है तथा चमक कम हो जाती है |
4Ln +3O2 → 2Ln2O3 |
- लैंथेनाइडो के उपयोग
- लैंथेनाइड सर्वोत्तम उपयोग प्लेट तथा पाइप बनाने के लिए मिश्र धातु इस्पात के उत्पादन में किया जाता है । लैंथेनाइड की मिश्र धातु मिश धातु है मिश धातु में Ln धातु (44.95%) ,Fe(5%) तथा C,S,Ca व Al के अंश होते हैं ।
- मिश धातु की अधिकतम मात्रा मैग्नीशियम आधारित मिश्र धातु में प्रयुक्त होती है जिसका उपयोग बंदूक की गोली ,कवच या खोल तथा हल्के फिलंट के उत्पादन में किया जाता है ।
- लैंथेनाइड के मिश्रित ऑक्साइड का उपयोग पेट्रोलियम भंजन में उत्प्रेरक के रूप में किया जाता है ।
- लैंथेनाइडके कुछ ऑक्साइडो का उपयोग स्फुरदीप्ति (फोस्फर) के रूप में टेलीविजन पर्दे पर किया जाता है ।
- CeO2 का उपयोग गैस मेटल के उत्पादन में किया जाता है ।
- एथाइन के ऑक्सीकरण से एथेनेल बनाने के वाकर प्रक्रम मे PdCl2 उत्प्रेरक कम मे लेते है ।
- फोटोग्राफिक उद्योग में AgBr का उपयोग करते हैं ।










1 Comment