अधिशोषण के प्रकार
1.भौतिक अधिशोषण – वह अधिशोषण जिसमें अधिशोषक एवं अधिशोष्य पदार्थों के मध्य दुर्बल वांडरवाल्स बंध पाया जाता है।
2.रासायनिक अधिशोषण – वह अधिशोषण जिसमें अधिशोषक एवं अधिशोष्य पदार्थों के मध्य रासायनिक बंध बनता है।
भौतिक अधिशोषण एवं रासायनिक अधिशोषण में अंतर
| भौतिक अधिशोषण |
रासायनिक अधिशोषण |
|
1.इसमें अधिशोषक एवं अधिशोष्य के मध्य वांडरवाल्स बंध पाया जाता है। 2. यह प्रक्रम उत्क्रमणीय होता है। 3. यह सामान्य प्रक्रम है। 4. यह ताप बढ़ाने से कम होता है। 5. यह अधिशोषण सरलता पूर्वक द्रवित होने वाली गैसों का ज्यादा है। |
1. इसमें अधिशोषक एवं अधिशोष्य के मध्य रासायनिक बंध पाया जाता है। 2. यह प्रक्रम अनुत्क्रमणीय होता है। 3. यह विशिष्ट प्रक्रम है। 4. यह उच्च ताप पर संपन्न होता है। 5. यह अधिशोषण तब संभव है जब कोई रासायनिक बंध बनने की संभावना हो। |
अवशोषण – वह रासायनिक क्रिया जिसमें पदार्थ के प्रत्येक भाग में सांद्रता समान पाई जाती है।
अधिशोषण और अवशोषण में अंतर
| अधिशोषण | अवशोषण |
|
1. इसमें सांद्रता सतह पर बढ़ती है । 2. यह एक सतही प्रक्रम होता है । 3. इसमें परतों का निर्माण होता है । 4. यह ताप बढ़ाने से कम होता है । 5. यह दाब बढ़ाने पर बढ़ता है । |
1. इसमें संपूर्ण भाग में सांद्रता एक समान रहती है । 2. यह एक आंतरिक प्रक्रम होता है । 3. इसमें परतों का निर्माण नहीं होता है । 4. यह ताप बढ़ाने पर अप्रभावित रहता है । 5. इस पर दाब का कोई प्रभाव नहीं पड़ता है । |
अधिशोषण समतापी – अधिशोषक के द्वारा अधिशोषित गैस की मात्रा और दाब में निश्चित ताप पर खींचे गए वक्र अधिशोषण समतापी कहलाते हैं।वैज्ञानिक फ़्रायण्डलिक ने अधिशोषक के इकाई द्रव्यमान द्वारा निश्चित ताप पर अधिशोषित गैस की मात्रा और दाब के मध्य संबंध बताने के लिए निम्न समीकरण दिया जिसे फ़्रायण्डलिक समीकरण कहते हैं।

दाब बढ़ाने पर अधिशोषण की दर बढ़ जाती है।
अर्थात अधिशोषण की दर

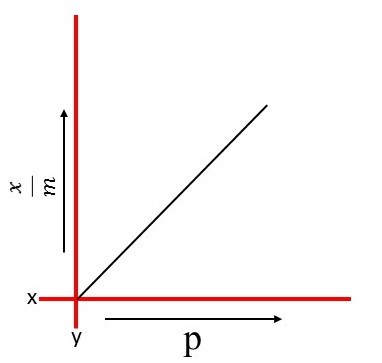
T1 > T2 > T3

उपरोक्त वक्र इंगित करता है की एक निश्चित दाब पर , ताप बढ़ाने से भौतिक अधिशोषण घटता है।
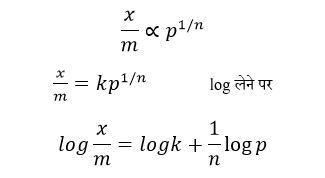
समीकरण से हम कह सकते है कि दाब उच्च होने पर यह असफल हो जाता है क्योंकि 1/n = 0

तो समीकरण
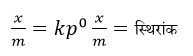
अर्थात अधिशोषण पर दाब का प्रभाव नही पड़ता है।
जबकि 1/n = 1 तो समीकरण

अर्थात अधिशोषण में परिवर्तन दाब के समानुपाती होता है।
अतः फ़्रायण्डलिक समतापी से उच्च दब पर अधिशोषण कों नही समझाया जा सकता है फ़्रायण्डलिक के द्वारा बतलाये गए अधिशोषण समतापियों से अधिशोषण की पूरी तरह व्याख्या नही होती है क्योंकि उच्च दाब पर वक्र संतृप्त हो जाते है इस प्रकार यह उच्च दाब पर असफल हो जाता है।

विलयन प्रावस्था से अधिशोषण
यदि CH3COOH के जलीय विलयन में थोडा सा चारकोल डालकर हिलाया जाये तो कुछ समय पश्चात विलयन में की मात्रा कम हो जाती है क्योंकि चारकोल के द्वारा CH3COOH का अधिशोषण कर लिया जाता है ।
उक्त प्रयोग में अधिशोषण की सीमा
- अधिशोषण की सीमा विलयन में विलेय की सांद्रता बढ़ने पर बढती है ।
- अधिशोषण की सीमा ताप बढ़ने पर घटती है ।
- अधिशोषण की सीमा अधिशोषक का पृष्ठीय क्षेत्रफल बढ़ने पर बढती है ।
दाब के स्थान पर विलयन की सांद्रता लेने पर