धातुओं के हैलाइड ,ऑक्साइड ,चुम्बकीय गुण ,रंग
6. धातुओं के हैलाइड एवं ऑक्साइड
संक्रमण तत्वों की ऑक्सीकरण अवस्था Ti ,V, Cr में पाई जाती है ये TiX4 ,VX5 व CrF6 हैलाइड बनाते हैं ।
उच्च ऑक्सीकरण अवस्था में हैलाइड सामान्यतः फ्लोराइड बनाते हैं क्योंकि F– का आकार छोटा होता है ।
मैंगनीज की +7 ऑक्सीकरण अवस्था सरल हैलाइड प्रदर्शित नहीं करती है ।
आयोडाइड के अतिरिक्त Cu2+ के सभी हैलाइड ज्ञात है क्योंकि Cu2+ आयन I– आयन को I2 ऑक्सीकृत कर देता है ।
2Cu2+ + 4I– → Cu2I2 + I2
अनेक Cu+ यौगिक जलीय विलयन में अस्थाई होते हैं क्योंकि Cu+ असमानुपातित होकर Cu2+ मे बदल जाते हैं । Cu2+ का स्थायित्व Cu+ से अधिक होता है इसके कारण इसकी जलयोजन एंथैल्पी ΔH0 का Cu+ की तुलना में बहुत अधिक -ve मान होता है जो कॉपर की द्वितीय आयनन एंथैल्पी की क्षतिपूर्ति से अधिक है । फ्लोराइड आयन आयनिक प्रकृति के होते हैं जबकि क्लोराइड ,ब्रोमाइड व आयोडाइड सहसंयोजक प्रकृति के होते हैं ।
V हैलोजन के साथ क्रिया करके VF5 , VCl5 , VBr3 ,VI5 बनाता है लेकिन VBr5 , या VI5 नहीं बनाता है क्योंकि +5 ऑक्सीकरण अवस्था में V प्रबल ऑक्सीकारक है जो Br– तथा I– को क्रमशः Br2 तथा I2 में ऑक्सिकृत कर देता है अतः VBr3 तथा VI3 बनते हैं जबकि VBr5 , तथा VI5 नहीं दूसरी तरफ VF5 बनता है क्योंकि V+5 आयन उच्च ऋण विद्युती और छोटे ऋणायन F– को ऑक्सिकृत करने में असमर्थ है । ठीक इसी प्रकार उच्च विद्युत ऋणी तथा छोटे O2- आयन के साथ यह तत्व ऑक्साइड बनाते हैं ।
| ऑक्सीकरण अवस्था | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | |
| +1 | Cu2O | |||||||||
| +2 | TiO | VO | CrO | MnO | FeO | CoO | NiO | CuO | ZnO | |
| +3 | Sc2O3 | Ti2O3 | V2O3 | Cr2O3 | Mn2O3 | Fe2O3 | ||||
| +4 | TiO2 | V2O4 | CrO3 | MnO2 | ||||||
| +5 | V2O5 | |||||||||
| +6 | CrO3 | |||||||||
| +7 | Mn2O7 |
फ्लोरिन की अपेक्षा ऑक्सीजन की इन उच्च ऑक्सीकरण अवस्थाओं को स्थाइत्व प्रदान करने की क्षमता अधिक होती है क्योंकि ऑक्सीजन धातुओं के साथ बहु आबंध बना लेता है इसलिए Mn का उच्चतम फ्लोराइड MnF4 तथा उच्चतम ऑक्साइड Mn2O7 है ।
7. चुम्बकीय गुण
वे पदार्थ जो बाहरी चुम्बकीय क्षेत्र द्वारा प्रतिकर्षित होते है प्रतिचुम्बकीय पदार्थ कहलाते है तथा जो बाहरी चुम्बकीय क्षेत्र द्वारा आकर्षित होते है अनुचुम्बकीय पदार्थ कहलाते है । जब परमाणु या आयन मे अयुग्मित इलेक्ट्रोन होते है तो वह अनुचुम्बकीय प्रकृति का होता है और जब इनके कक्षक पूर्ण भरे होते है अर्थात युग्मित इलेक्ट्रोन होते है तो पदार्थ प्रतिचुम्बकीय प्रकृति का होता है पूर्ण भरे कक्षक मे दोनों इलेक्ट्रोन के चुम्बकीय आघूर्ण एक दूसरे द्वारा निरस्त हो जाते है क्योंकि एक कक्षक मे इलेक्ट्रोन विपरीत चक्रण के होते है ।
पदार्थ मे चुम्बकीय गुणों को चुम्बकीय आघूर्ण के द्वारा ज्ञात किया जाता है इसको म्यू के द्वारा प्रदर्शित करते है तथा चुम्बकीय आघूर्ण की इकाई बोर मैग्नेटोन(BM) होती है ।
चुम्बकीय आघूर्ण निम्न सूत्र द्वारा निकालते है ।![]() 8. रंग
8. रंग
संक्रमण तत्वों मे यौगिक ठोस अवस्था व विलयन दोनो मे रंगीन होते है क्योंकि इनमेंअयुग्मित इलेक्ट्रॉन युक्त d – कक्षक होते है । जब संक्रमण धातु परमाणु या आयन के पास लिगेंड आता है तो d उपकोश के कक्षक दो क्षेत्रों मे विभाजित हो जाते है ।
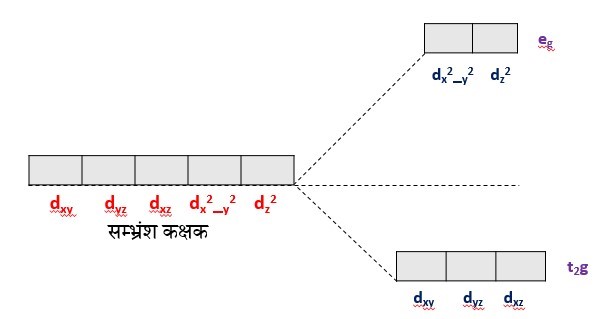
जब इलेक्ट्रोन निम्न ऊर्जा के d-कक्षक से उच्च ऊर्जा के d-कक्षक मे जाता है तो d-d संक्रमण कहलाता है अयुग्मित इलेक्ट्रॉन के d-d संक्रमण मे जिस रंग के प्रकाश का अवशोषण होता है तो उसका पूरक रंग दिखाई देता है वे संक्रमण धातु आयन जिनमे d-कक्षक पूर्ण भरे होते है वे रंगहीन होते है क्योंकि इनमे d-d संक्रमण संभव नही है ।
जैसे – Cu+, Ag+, Zn++
संक्रमण धातुओं के वे आयन भी रंगहीन होते है जिनमे सभी d-कक्षक रिक्त होते है जैसे – Ti4+









4 Comments