आलिंघम आरेख के अनुप्रयोग
आयरन ऑक्साइड से लोहा प्राप्त करना
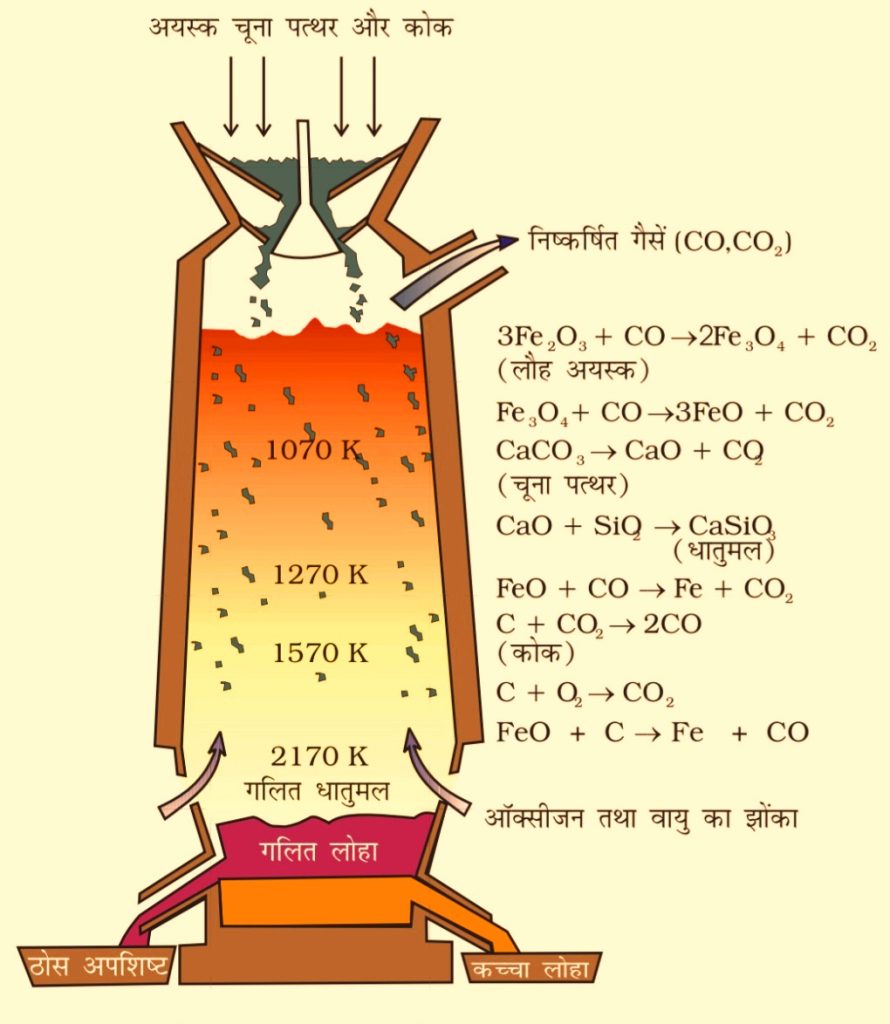
सामान्यतः हेमेटाइट(Fe2O3) से लोहा प्राप्त किया जाता है इसके लिए हेमेटाइट को कोक तथा चूने के साथ मिलाकर भट्टी में डाला जाता है भट्टी स्टील की बनी होती है इसके अंदर की दीवारों पर अग्नि सह ईंटों का अस्तर होता है तथा बाहर की तरफ जल प्रवाहित होता रहता है भट्टी के अलग-अलग भागों में तापमान अलग-अलग होता है इसलिए अलग-अलग भागों में अलग-अलग अभिक्रिया होती है । भट्टी के निचले भाग में जहां तापमान अत्यधिक होता है वहां कार्बन का अपूर्ण दहन होता है वहां CO बनती है जो ऊपर की ओर बढ़ती है जहां हेमेटाइट तथा फेरस ऑक्साइड का अपचयन अलग-अलग प्रकार से होता है अंततः कच्चा लोहा प्राप्त होता है ।
अभिक्रियाएं निम्न है ।
- 500-800k ताप पर
Fe2O3 + CO → 2FeO + CO2
2Fe2O3 + CO → 2Fe3O4 + CO2
Fe2O4 + CO → 3FeO + CO2
- 900-1500k ताप पर
C + CO2 → 2CO
FeO + CO → Fe + CO2
FeO + C →Fe + CO
भट्टी मे होने वाली अभिक्रिया को आलिंघम आरेख से समझ सकते है ।
FeO + C → Fe + CO
यह अभिक्रिया निम्न दो पदों का योग है
FeO → Fe + ½ O2 [ΔGFeO→Fe]
C + ½ O2 → CO [ΔGC→CO]
ΔrG = ΔGFeO→Fe + ΔGC→CO
जब ΔrG का मान ऋणात्मक होगा तब कार्बन के द्वारा फेरस ऑक्साइड का अपचयन हो जाएगा तापमान बढ़ाने पर ΔrG अधिक ऋणात्मक होता है तथा वह तापमान जिस तापमान पर उपरोक्त अभिक्रिया के लिए ΔrG ऋणात्मक हो जायेगा उसी तापमान पर कार्बन के द्वारा फेरस ऑक्साइड का अपचयन होगा ।
आलिंघम आरेख में इस तापमान को Fe→FeO तथा C→CO ग्राफ के प्रतिच्छेद बिंदु द्वारा प्रदर्शित किया जाता है इस बिंदु के बाद C →CO वाला ग्राफ Fe→FeO वाले ग्राफ के नीचे आ जाता है तथा ΔrG का मान भी ऋणात्मक हो जाता है और कार्बन के द्वारा आसानी से फेरस ऑक्साइड का अपचयन हो जाता है ।
वात्या भट्टी में प्राप्त लोहे में लगभग 4% कार्बन होता है जिसे कच्चा लोहा या पिग आयरन कहा जाता है पिग आयरन को रद्दी लोहे और कोक के साथ भट्ठी में गर्म करने से ढलवा लोहा प्राप्त होता है जिसमें लगभग 3% कार्बन होता है ढलवा लोहे को हेमेटाइट का अस्तर लगी हुई भट्टी में गर्म करने से इसका अधिकांश कार्बन कार्बन मोनोऑक्साइड व कार्बन डाइऑक्साइड के रूप में वाष्पित हो जाता है तथा पिटवा लोहा प्राप्त होता है पिटवा लोहा वाणिज्यिक लोहे का शुद्धतम रूप है ।
कॉपर के ऑक्साइड से तांबे का निष्कर्षण
आलिंघम आरेख में [ΔGϴ व T के मध्य] Cu2O का ग्राफ सबसे ऊपर है अतः इसका अपचयन आसान होता है ग्राफ में देखने पर पता चलता है कि 500k-600k तापमान के मध्य ही C → CO वाला ग्राफ Cu → Cu2O वाले ग्राफ के नीचे आ जाता है अतः कार्बन के द्वारा इस कम तापमान पर ही अपचयन हो जाएगा ।
आलिंघम आरेख के अनुप्रयोग